金斯瑞控股子公司南京传奇更新LCAR-B38M疗法
近日,金斯瑞子公司南京传奇公布了其一项CAR-T疗法的新进展。相关数据显示,接受这项疗法的患者总缓解率(ORR)为88%,74%(42名)患者达到了完全缓解(CR)。此前,南京传奇陷入数据造假风波,而此次披露的数据并未完全消除各方对其的质疑。
刚刚结束的第60届美国血液病学会(ASH)年会上,金斯瑞(01548.HK)控股子公司南京传奇更新了LCAR-B38M疗法的最新安全性与有效性数据,这是自2017年美国临床肿瘤学会(ASCO)年会以来,南京传奇对CAR-T疗法LCAR-B38M研究结果的首次展示。
南京传奇的临床研究数据显示,截至2018年6月25日,57名多发性骨髓瘤晚期患者接受了LCAR-B38M疗法,患者总缓解率(ORR)为88%,74%(42名)患者达到了完全缓解(CR),4%的患者达到了非常好的部分缓解(VGPR),11%的患者达到了部分缓解(PR)。而且,42名完全缓解的患者中,39位经检测微小残留病灶(MRD)呈阴性。
此前,金斯瑞陷入临床试验数据造假风波。今年9月,阎火研究发布报告称,金斯瑞CAR-T疗法选择性披露数据并隐瞒死亡案例来推高预期,最终估值仅为每股3.29港币。金斯瑞因此股价暴跌40%以上。
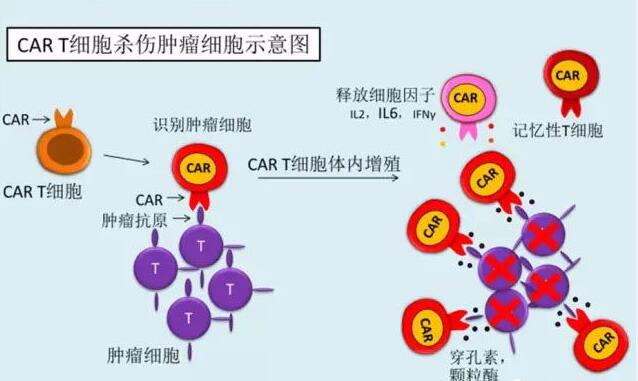
临床试验数据仍有争议
阎火研究报告从技术源头、工艺挑战、数据真实性等7个角度分析了南京传奇的造假行为。关于阎火研究的公开介绍资料很少,其官网显示,阎火研究是由一群资深的股票投资者发起的独立研究机构。
9月28日,金斯瑞正式发布澄清报告,否认阎火研究的所有指控。
关于在2017年ASCO会议上公布的临床试验数据涉嫌造假,选择性选择西安临床试验数据披露的问题,金斯瑞指出当时会议于2017年6月举行,但论文截止日期是2017年2月,南京传奇与上海瑞金医院、上海长征医院和江苏省人民医院的合作均是在截止日期后才展开,因此这些数据未能在2017年6月份ASCO大会上发布。
除了数据问题,南京传奇CAR-T临床试验中受试者死亡事件也备受关注,根据金斯瑞公告,2017年9月16日一名于上海长征医院接受治疗的患者不幸离世。
但金斯瑞始终没有正面回应个案死亡的具体原因。
10月1日,阎火研究发布了第二份报告,认为金斯瑞回应避重就轻,进一步误导投资者。金斯瑞否认第二份报告针对集团的所有指控,并表示已就两份报告采取必要的法律行动。
因为涉嫌数据造假风波,南京传奇在ASH年会上公布数据引发多方关注。
而南京传奇此次公布的临床试验数据,其选择性披露数据的质疑并未完全消除,关于LCAR-B38M的数据“至少可以说是有争议的”,Leerink分析师Porges近日接受媒体采访时表示。
截至目前,LCAR-B38M疗法共有74个受试者,研究在四个试点展开。临床中心西安交大二附院是患者招募入组的主要负责方(该院招募了57个受试者),本次也只公布了这57位患者的数据。参与研究的其他三个试点上海瑞金医院、上海长征医院和江苏省人民医院还共招募了17名患者,但此三处试点的数据没有公布。这三处的信息只在2017年ASH年会上披露过一次,当时详细介绍了在这三个地点接受治疗的11名患者,其中8例sCR,2例VGPR,1例PR,总缓解率达100%。
南京传奇的首席科学馆范晓虎博士近日向BioCentury(美国生物医药行业咨询公司)表示,这三处试点的17名患者的数据集“在安全性和疗效方面与此非常一致”,并可能很快出现在同行评议的期刊中。
新公布的数据中有一例死于2级细胞因子释放综合征的呼吸困难也引起了关注。范晓虎博士告诉BioCentury,死亡与治疗研究无关。该患者虽然患有2级CRS但当时已解决,并且患者有冠状动脉疾病史。
“与南京传奇合作的强生团队,许多医学博士和来自南京传奇的专家对此案进行了审查,并没有将其归因于直接使用CRS或注射CAR-T”,范晓虎说,由于审查是由调查人员发起的,所以要由个别调查人员决定他们何时何地报告结果,而不是南京传奇。南京传奇和强生一直在密切合作,以确保试验的质量,“这些数据经过了仔细研究,每一项记录都得到了证实或核实。”
LCAR-B38M疗法究竟是什么?
2017年6月,在美国临床肿瘤学会(ASCO)年会上,南京传奇凭借其利用CAR-T技术在治疗复发/难治性多发性骨髓瘤病人的早期临床试验数据达到100%的客观缓解率,引起了肿瘤治疗领域的极大关注。
该项研究挑选了35 名复发性或耐药性的多发性骨髓瘤患者,接受LCAR-B38M 治疗2个月后,其客观缓解率(ORR)高达100%,33名患者(94%)获得临床缓解,显示明显的骨髓瘤临床缓解迹象(CR或VGPR)。
2017年12月,强生公司与南京传奇签署了共同开发针对多发性骨髓瘤的CAR-T细胞疗法全球战略合作协议,强生支付了3.5亿美元首付款以及后续里程碑付款,共同开发、生产和销售LCAR-B38M。双方共同承担成本和分享受益:大中华区比例为 7:3,金斯瑞占7;其它市地区则五五分。这项合作创下中国药企对外专利授权首付款最大金额与合作最优条件。
2017年12月11日,南京传奇的LCAR-B38M CAR-T细胞自体回输制剂在中国递交临床申请,并且获得原CFDA受理,母公司金斯瑞股票因此涨幅超过450%。
2018年3月12日,LCAR-B38M 获CFDA的临床试验批件,成为我国首个获批临床的CAR-T疗法。5月底,LCAR-B38M 获美国FDA开展针对复发/难治性多发性骨髓瘤的1b/II期临床试验的许可,8月底,美国第一例病人已入组。
LCAR-B38M是一款靶向成熟B细胞成熟抗原(BCMA)的CAR-T疗法。BCMA表达于多发性骨髓瘤(MM)细胞和多发性骨髓瘤患者恶性浆细胞,适合作为 MM 治疗的靶点,同时并不会使得正常 B 细胞的功能受到明显影响。
南京传奇的CAR-T抗体结构又非常独特。目前全球的CAR-T技术都采用源于老鼠的抗体结构来设计,而南京传奇的研发团队创新性地采用美洲驼体内的一种抗体结构,该抗体仅有可变区重链(VH),重链序列与人高度相似,免疫原性较小,并且持久性较强。
由于不需要轻链结构,南京传奇的这一抗体可以设计得非常小,使得公司可以采用双表位技术,即同时靶向两个不同的表位,因此脱靶率低,副作用小。这种双特异性抗体的临床效果也更为突出。
2018年8月,南京传奇开始国内招募二期临床研究的患者,研究将在国内8家医院进行,预计入组人数为60人,入组条件为接受过三种及以上多发性骨髓瘤治疗。而美国1b/II期的试验估计有60名参与者,预计将于2020年7月完成。
BCMA靶点竞争激烈
2017 年被称为全球“细胞治疗元年”,CAR-T 疗法成为人类战胜癌症的新希望。该疗法从患者体内分离获取T淋巴细胞,在实验室中进行基因修饰后再回输给患者,让经修饰的T细胞将长期存在于患者体内,能持续地杀灭癌症细胞。目前,全球 CAR-T 细胞免疫疗法仅在血液瘤领域取得巨大进展。
在血液病三大类恶性肿瘤中,2017 年美国 FDA 分别批准了针对淋巴瘤和白血病的两款CAR-T 药物首次上市,但对于更难医治的多发性骨髓瘤尚无 CAR-T 药物上市。
多发性骨髓瘤(Multiple Myeloma,MM)是由于骨髓中浆细胞癌变导致的血癌,在血癌中的发病率仅次于白血病和淋巴瘤。目前全球约有 75 万例患者,每年新发病例约 16 万例。
ASH年会上一项第三阶段研究结果显示,强生的达雷木单抗(Darzalex)和主要的多发性骨髓瘤药物来那度胺(Revlimid)和地塞米松(一种免疫抑制类固醇)联合使用,将新诊断出不符合骨髓移植计划的患者的死亡风险降低了44%。
但多发性骨髓瘤的棘手问题在于它的持久性,大多数人最终几乎都会复发。这意味着尽管有更新的药物和组合可以使患者长期缓解,制药商仍然有机会进入治疗模式。
对于复发的患者来说,靶向BCMA的CAR-T疗法可能是治愈的有力武器。
全球各生物制药公司在BCMA上投入了大量资金,该领域的竞争日益激烈。ASH会前报道的数据摘要里,至少51篇涉及BCMA相关内容,其中包括来自Bluebird Bio和合作伙伴新基制药(Celgene),南京传奇和合作伙伴强生,Poseida Therapeutics ,CARsgen Therapeutics和纪念斯隆·凯特琳癌症中心的一系列CAR-T疗法。
彭博社指出,Bluebird Bio和Celgene的bb2121在以前治疗过的复发性骨髓瘤的BCMA靶向治疗中处于领先地位。到目前为止,bb2121最有可能进入FDA,该治疗在2017年获得FDA的突破性疗法认定(BTD),并且还获得了欧洲药品管理局(EMA)的优先药物资格(PRIME)。
在ASH年会上,Bluebird Bio和Celgene没有更新bb2121的数据,但提供了正在进行的bb21217 I期临床试验的初步数据,bb21217是在bb2121基础上开发,用于复发/难治性多发性骨髓瘤的第二代CAR-T疗法。其通过结合一种PI3K抑制信号,从而能够刺激幼生(younger)T细胞,这是一种反应更持久、更强效的T细胞亚群,在临床前研究中表现出很强的抗肿瘤活性。
bb21217临床试验中的患者群体已接受至少三次先前治疗。12名患者的客观缓解率为83.3%。10名患者中有9名持续做出反应,其中3名患者为完全缓解(CR)或严格意义的完全反应(sCR),2名患者报告了非常好的部分缓解(VGPR),4名患者部分缓解(PR)。不过,患者中有8例(67%)出现细胞因子释放综合征(CRS),其中大多数为1级或2级严重程度。有3例(25%)患者出现神经毒性,所有CRS和神经毒性事件均得到解决,研究中未发生死亡。
Celgene多管齐下的BCMA策略引人注目,除了与Bluebird的合作,Celgene通过收购Juno Therapeutics开发了第三个BCMA CAR-T疗法项目JCARH125。
最大的惊喜可能来自Poseida Therapeutics,这是一家位于加利福尼亚州圣地亚哥的私人控股公司,正在开发P-BCMA-101疗法。Poseida在ASH表示,明年将开始一项关键性研究,并在2020年底前提交审批,这将使得P-BCMA-101与Bluebird 和Celgene领先的bb21217处于相同的发展时间表。
在ASH,Poseida披露了迄今为止P-BCMA 101上最详细的数据。截至数据截止日期,共有23名患者接受了五个剂量组的治疗,19名可评估的至少6次治疗失败的患者中有15名对其实验性P-BCMA-101有反应。
P-BCMA-101使用piggyBac™DNA修饰系统而不是病毒载体生产,成本更低且更安全,其显著性特征是该产品中记忆性干细胞样T细胞(TSCM)所占比例很高,这是增加反应持续时间的关键。
当前针对BCMA靶点开发的治疗复发/难治性多发性骨髓瘤的免疫疗法主要分为3大类,除了CAR-T细胞疗法之外,还包括双特异性抗体(BsAb)、抗体药物偶联物(ADC)。
在ASH年会上,GSK公布了抗BCMA抗体药物偶联物GSK2857916 的最新数据,安进(Amgen)和辉瑞也分别公布了两款双特异性抗体药物AMG 420 和PF-06863135的临床结果。
一些行业人士认为,这些药物比基于细胞的CAR-T疗法更便宜、更安全,后者可能有严重的副作用,比如患者容易出现细胞因子释放综合征(CRS)。
彭博行业研究(Bloomberg Intelligence)的Asthika Goonewardene评论,截至目前为止还没有任何一家公司展示出对复发/难治性多发性骨髓瘤根本性的治愈,使得其能从这场竞赛中脱颖而出。
“这无疑是一次机会”Asthika说道,“目前已经有大量的病人已经用尽了已有的治疗方式,正需要一种新的治疗手段。”
推荐内容
-
7招叫你从容面对生活变数
现实生活中,我们很难揣测出一个人的心理活动。但是我们可以根据一些知识的细节,去假设判断一些人的心理,也包括对自己的心理的认知。 1
-
科学家揭示了细菌DNA中隐藏的结构
DNA包含基因内编码的生命指令。在所有细胞中,DNA被组织成非常长的长度,称为染色体。在动物和植物细胞中,这些是双端的,如细绳或鞋带,但
-
为何人在思考的时候会抬头闭眼?
心理活动是每个人都有的。然而这样一个别人不知道的思想角落,往往容易被他人忽视。所以我们自身必须时刻关注自己的内心需求,不能让自...
-
免洗洗手液清洁力不强还对皮肤不好?你知道哪些
日常生活中我们经常会听到各种各样的坊间流言。然而很少人去求证这些流言的真实性,久而久之就变成了真事。在这里,小编必须提醒大家,...