团队成功分析了蛋白质FAT10的结构以进行潜在的癌症治疗
FAT10是一种具有巨大影响的小蛋白质。它与靶蛋白的连接是其降解的信号。FAT10是降解的标记系统,似乎效率低下。与其生物竞争者泛素一起被回收,FAT10与其目标蛋白质一起被降解,乍一看似乎是浪费。
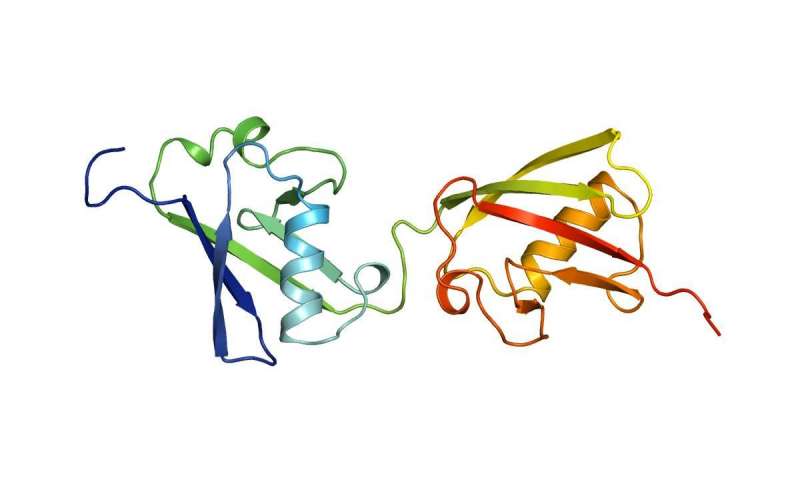
那么为什么这个看似效率低下的FAT10系统依然存在呢?康斯坦茨大学免疫学家Marcus Groettrup及其团队多年来一直在研究FAT10。现在,他们报告了FAT10的高分辨率结构。通过另一项成就实现了这一成功。与来自生物技术研究所Thurgau(BITg)的Annette Aichem博士,康斯坦茨化学家Christine Peter教授和来自雷根斯堡大学的结构生物学家Silke Wiesner博士合作,该团队开发了一种分子技术,用于生产稳定且高浓度的FAT10。高纯度。因此,研究人员可以通过X射线晶体学和磁共振光谱对FAT10进行结构分析。结果发表在最新一期的Nature Communications上。
“我们在FAT10中发现了一种与泛素完全不同的机制。这种机制对于整个泛素领域非常有趣,”Groettrup说。与具有一个结构域的遍在蛋白相比,FAT10具有两个结构域,即能够使蛋白质起作用的折叠。该团队现在已经发现这两个域都通过灵活的连接器连接,并且它们的折叠比泛素的压缩要小得多。重要的是,FAT10具有短暂的无序扩展。
实验表明,FAT10蛋白的松散折叠和无序延伸具有重要的调节功能,实际上简化了靶分子的降解。结果,在遍在蛋白系统中,不需要复杂的部分底物去折叠的上游过程,以使具有实际进行降解的酶26S蛋白酶体起作用。由于FAT10域的松散折叠,这是多余的。该酶靶向无序部分并且可以容易地展开两个柔性且松散折叠的结构域,因此可以拉开附着的靶蛋白并降解它。
之前已经知道泛素和FAT10具有完全不同的结合特性。考虑到两种蛋白质结构域的折叠基于相同的结构,这就更令人惊讶了。研究小组的研究结果现在解释了原因:FAT10和泛素的表面完全不同,它们决定了哪些蛋白质被结合。因此,两个标记系统都具有不同的交互伙伴。FAT10主要存在于炎性组织中。“没有炎症,它几乎根本不存在,”Groettrup说。在他看来,标记系统与蛋白质一起被破坏是有利的。他的假设是:在这种情况下,自然依赖于不可逆性,因此蛋白质降解无法逆转。
关于FAT10的另一个有趣的事实,Groettrup说,“在13种不同类型的癌症中,它被发现有更大的程度。我们可以得出结论,FAT10有利于癌细胞的存活和生长。”例如,如果FAT10与抑制肿瘤生长的蛋白质相关联,它们就会被降解,肿瘤细胞可以更容易地生长。对于这样的情况,可以设想开发抑制连接FAT10和靶蛋白的酶的癌症药物。“谈到实际实施,我们的研究结果实际上为希望提供了理由,”Groettrup总结道。
推荐内容
-
10月28日张家口蔚县疫情最新消息公布 张家口蔚县公布次密接轨
张家口蔚县公布次密接轨迹,涉学校、饭馆、宾馆等。据消息显示,蔚县融媒体中心微信公众号京西第一州蔚县27日发布通告称,2021年10月26日22
-
搜狐医药 | 北京调整风险等级!新增一高风险一中风险
搜狐医药 | 北京调整风险等级!新增一高风险一中风险 原标题:搜狐医药 | 北京调整风险等级!新增一高
-
用无人机收集鲸鱼鼻涕
鲸鱼是这个星球上有史以来最大的已知动物。这使得从他们收集数据成为一项庞大而且往往是危险的任务。对于像Macquarie大学博士候选人Vanessa
-
上海新增本土死亡47例,最大年龄101岁
上海新增本土死亡47例,最大年龄101岁 原标题:上海新增本土死亡47例,最大年龄101岁
-
郑爽否认与张翰复合 安慰粉丝“别难过哈”
说起张翰,郑爽,想必大家都很熟悉了,两人曾是在拍摄《一起来看流星雨》中而相识相恋的,可到最后却是因为郑爽的不自信而分手,如今六...
-
胃最怕这“几件事”,多占一个离胃癌就近一分!
胃最怕这“几件事”,多占一个离胃癌就近一分! 原标题:胃最怕这“几件事”,多占一个离胃癌就近一分!
-
全球变暗可能会缓解变暖但可能会影响作物产量
通过向高层大气层添加一层粒子遮蔽地球可能有助于抵消全球变暖 - 但需要付出代价。研究人员在8月8日的 自然杂志网络版上报告说,作物产
-
塑料污染增加了珊瑚中毁灭性疾病的风险
珊瑚礁生病了。一项新的估计发现,超过110亿个塑料物体正在污染亚太珊瑚礁。这种废物可能含有导致珊瑚生病的致病菌。研究人员说,充满塑料
-
学者发现5亿多年前四不像动物 俗称四不像的动物是什么?
章氏麒麟虾身体具有明显的真节肢动物特征,例如硬化的表皮、愈合的头壳、多节的躯干和分节的腿肢。章氏麒麟虾组合了真节肢动物和节肢动...
-
坐月子不能洗头吗?
坐月子不能洗头吗? 原标题:坐月子不能洗头吗?