高中化学-碳酸钠和碳酸氢钠的性质与应用练习
-
高中化学-碳酸钠和碳酸氢钠的性质与应用练习
一、选择题
1.关于Na
2
CO
3
的性质,下列说法错误的是()
A.相同温度下溶解度比NaHCO
3
要大
B.Na
2
CO
3
是盐,其水溶液显中性
C.热稳定性比NaHCO
3
强
D.和酸反应放出等量的CO
2
时消耗的酸比NaHCO
3
多
解析:Na
2
CO
3
俗名纯碱,是盐,其水溶液呈碱性;热稳定性:Na
2
CO
3
>NaHCO
3
;D项中,Na
2
CO
3
+2HCl===2NaCl+CO
2
↑+H
2
O,NaHCO
3
+HCl===NaCl+CO
2
↑+H
2
O.
答案:B
2.下列有关碳酸钠与碳酸氢钠的说法不正确的是()
A.在通常状况下,都是白固体
B.它们都易溶于水
C.在通常状况下,受热都易分解
D.都可以和盐酸反应并生成CO
2
气体
解析:碳酸钠与碳酸氢钠一个显著的区别就是热稳定性,碳酸氢钠受热易分解,而碳酸钠
受热不分解.
答案:C
3.鉴别碳酸钠与碳酸氢钠两种无溶液最好的方法是()
A.加稀硫酸
C.加氯化钙溶液
B.加热
D.加Ba(OH)
2
溶液
解析:A项均能产生气体;D项均能产生沉淀;B项溶液加热无现象;C项CaCl
2
与Na
2
CO
3
可直接产生沉淀,而与NaHCO
3
溶液没有沉淀.
答案:C
4.为除去实验室制得的CO
2
气体中的少量HCl气体,最好将混合气体通过()
A.烧碱溶液
C.饱和碳酸钠溶液
B.饱和碳酸氢钠溶液
D.水
解析:既不能和CO
2
反应且又能吸收HCl产生CO
2
的只有NaHCO
3
.
答案:B
5.下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是()
-5-
A.Na和O
2
C.NaHCO
3
和NaOH
B.NaOH和CO
2
D.Na
2
CO
3
和HCl
解析:Na和O
2
在常温下反应生成Na
2
O,加热时生成Na
2
O
2
;NaOH与CO
2
反应时,CO
2
过量生
成NaHCO
3
,不足时生成Na
2
CO
3
;Na
2
CO
3
与盐酸反应时,HCl过量,则生成CO
2
,不足时生成
NaHCO
3
.
答案:C
6.用1L1mol·L-1的NaOH溶液吸收0.8molCO
2
,所得溶液中Na
2
CO
3
和NaHCO
3
的物质的量
之比为()
A.1∶3
C.2∶3
B.1∶2
D.3∶2
解析:设生成的碳酸钠和碳酸氢钠的物质的量分别为xmol、ymol,则根据钠原子守恒,
可得2x+y=1,根据碳原子守恒,可得x+y=0.8,解得x=0.2,y=0.6,所以x∶y=1∶3,
A项正确.
答案:A
7.在10mL0.1mol·L-1的纯碱溶液中,不断搅拌并逐滴加入1.2mL0.5mol·L-1盐酸,
完全反应后在标准状况下生成二氧化碳的体积为()
A.1.34mL
C.0.672mL
B.2.240mL
D.0mL
解析:纯碱中逐滴加入盐酸并在不断搅拌的条件下先后发生的反应为①Na
2
CO
3
+
HCl===NaHCO
3
+NaCl,②NaHCO
3
+HCl===NaCl+H
2
O+
CO
2
↑,从题给的数据看,两者只能按①式进行反应,所以无气体放出.
答案:D
8.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物
质后冷却,残留的固体物质是()
A.Na
2
CO
3
C.NaOH、Na
2
CO
3
B.Na
2
O
2
、Na
2
CO
3
D.Na
2
O
2
、Na
2
CO
3
、NaOH
解析:碳酸氢钠固体受热先发生分解反应,化学方程式可表示为2NaHCO
3
=====Na
2
CO
3
+CO
2
↑
+H
2
O↑,生成的CO
2
和H
2
O均能与Na
2
O
2
反应:2CO
2
+2Na
2
O
2
===2Na
2
CO
3
+O
2
、2H
2
O+
△
-5-
2Na
2
O
2
===4NaOH+O
2
↑,若CO
2
过量时还会与NaOH反应:2NaOH+CO
2
===Na
2
CO
3
+H
2
O,所以为
计算方便可先考虑CO
2
与Na
2
O
2
反应,从而得关系式2NaHCO
3
~CO
2
~Na
2
O
2
,故1molNa
2
O
2
与2molNaHCO
3
分解生成的CO
2
恰好完全反应,最终所得残留固体只有Na
2
CO
3
.
答案:A
9.下列溶液反应后,溶液内含有0.5molNaHCO
3
和0.5molNa
2
CO
3
的是()
A.0.5L1mol·L-1NaHCO
3
加0.5L0.5mol·L-1NaOH
B.0.5L0.75mol·L-1Na
2
CO
3
加0.5L0.5mol·LHCl-1
C.0.5L1mol·L-1NaHCO
3
加0.5L0.25mol·L-1NaOH
D.1L1mol·L-1Na
2
CO
3
加1L0.5mol·L-1HCl
解析:A选项中发生反应NaHCO
3
+NaOH===Na
2
CO
3
+H
2
O,NaHCO
3
过量,最后溶液中有生成的
0.25mol的Na
2
CO
3
和0.25mol的NaHCO
3
;B选项中是0.375mol的Na
2
CO
3
和0.25mol的
HCl,发生反应Na
2
CO
3
+HCl===NaHCO
3
+NaCl,反应后溶液中有0.25mol的NaHCO
3
和0.125
mol的Na
2
CO
3
;C选项发生反应NaHCO
3
+NaOH===Na
2
CO
3
+H
2
O,剩余0.375mol的NaHCO
3
和
生成的0.125mol的Na
2
CO
3
;D选项发生反应Na
2
CO
3
+HCl===NaHCO
3
+NaCl,Na
2
CO
3
过量,
剩余0.5mol,生成0.5mol的NaHCO
3
,符合题意.
答案:D
10.将0.4gNaOH和1.06gNa
2
CO
3
混合并配成溶液,向溶液中滴加0.1mol·L-1的稀盐酸.
下列图像能正确表示加入稀盐酸的体积和生成CO
2
的物质的量的关系的是()
-5-
解析:配成的混合溶液中NaOH、Na
2
CO
3
分别为0.01mol,滴加稀盐酸时,先与NaOH反应,
消耗0.01molHCl,然后与Na
2
CO
3
反应生成NaHCO
3
,消耗0.01molHCl,再与NaHCO
3
反
应生成CO
2
,消耗0.01molHCl,生成0.01molCO
2
,C项正确.
答案:C
11.有两份质量相同的NaHCO
3
固体,向第一份中加入盐酸使其充分反应;将第二份加热使其
完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积
比为()
A.2∶1
C.1∶2
B.1∶1
D.4∶1
解析:本题可从Na+守恒角度考虑.无论NaHCO
3
是直接与盐酸反应,还是先加热分解后再
与盐酸反应,Na+的量不变,生成的NaCl的量相等,则消耗盐酸的量相等.
答案:B
二、非选择题
12.如图装置中:
-5-
加热试管内的白固体A(A的焰反应为黄),生成白固体B并放出气体C和D,这些
气体通过甲瓶的浓硫酸后,C被吸收;D进入乙瓶跟另一淡黄固体E反应生成白固体B
和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D.
(1)写出各物质的化学式:
A________;B________;C________;
D________;E________;F________.
(2)实验结束时,正确操作是________(填字母代号);目的是______________.
A.先将导管从液体中移出,再熄灭酒精灯
B.先熄灭酒精灯,再将导管从液体中移出
(3)写出试管中及丙瓶中反应的化学方程式:
试管中_________________________________________________________.
丙瓶中_________________________________________________________.
解析:A的焰反应为黄,说明A中含有钠元素,因为A――→B+C↑+D↑,所以A为
NaHCO
3
,B为Na
2
CO
3
.浓硫酸可以吸收水蒸气,所以C为H
2
O,D为CO
2
,CO
2
能够和淡黄的
Na
2
O
2
固体反应生成Na
2
CO
3
和O
2
,所以E为Na
2
O
2
,F为O
2
.
答案:(1)NaHCO
3
Na
2
CO
3
H
2
OCO
2
Na
2
O
2
O
2
(2)A防止倒吸
△
(3)2NaHCO
3
=====Na
2
CO
3
+CO
2
↑+H
2
O
2NaOH+CO
2
===Na
2
CO
3
+H
2
O
13.工业纯碱中常含有少量的NaCl杂质.如图所示的装置可用来测定纯碱中Na
2
CO
3
的质量分数,
图中标号分别代表下列物质:①空气、②某溶液、③纯碱样品、④稀硫酸、⑤浓硫酸、⑥
-5-
△
碱石灰、⑦碱石灰.
实验步骤:
①检查装置的气密性;②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m
1
g);③准确称量
一定量的纯碱的质量(设为m
2
g),并将其放入广口瓶中;④从分液漏斗中缓缓滴入稀硫酸,
至不再产生气体为止;⑤缓缓通入空气数分钟,然后称量干燥管Ⅰ的质量(设为m
3
g);根
据上述实验,回答下列问题:
(1)通入空气的目的是_____________________________________________.
(2)装置A中液体②应为__________,其作用是________________.如果撤去装置A,直接
向装置B中缓缓通入空气,测定的结果将__________(填“偏大”“偏小”或“不变”).
(3)装置C的作用是__________,如果撤去装置C,会导致实验结果__________(填“偏
大”“偏小”或“不变”).
(4)干燥管Ⅱ的作用是_____________________________________________.
(5)上述实验操作的④和⑤,都要求缓缓进行,其理由是________________,如果这两步
操作太快,则会导致测定结果__________(填“偏大”“偏小”或“不变”).
(6)根据实验,纯碱中Na
2
CO
3
的质量分数的计算式为__________.
解析:(1)实验完毕后整套装置中残留有CO
2
,通入空气的目的是将残留的CO
2
带入干燥管
Ⅰ中使其被碱石灰吸收.(2)通入的空气中也含有CO
2
,如果不除去会使测定的结果偏大,
用NaOH溶液可完全吸收通入的空气中的CO
2
,以免影响实验结果.(3)装置C中浓硫酸可以
吸收从装置B中出来的CO
2
中的水蒸气,避免水蒸气被干燥管Ⅰ中的碱石灰吸收,影响CO
2
质量的测定,使测定结果偏大.(4)干燥管Ⅰ的末端如果直接与空气接触,会吸收空气中的
水蒸气和CO
2
,使测得CO
2
的质量偏大,干燥管Ⅱ的作用是防止空气中的水蒸气和CO
2
进入
干燥管Ⅰ中.(5)缓缓进行可使生成的CO
2
被干燥管Ⅰ中的碱石灰充分吸收,如果操作太快
会使测得CO
2
的质量偏小,导致测定结果偏小.(6)由题可知:Na
2
CO
3
与稀硫酸反应产生的
CO
2
的质量为(m
3
-m
1
)g,其物质的量为
m
3
-m
1
44
mol,进而可知原样品中Na
2
CO
3
的物质的量为
-5-
m
3
-m
1
44
mol,质量为
106(m
3
-m
1
)53(m
3
-m
1
)
g.则样品中Na
2
CO
3
的质量分数为×100%.
4422m
2
答案:(1)赶走残留在装置中的CO
2
(2)NaOH溶液除去空气中的CO
2
偏大
(3)除去CO
2
中的水蒸气偏大
(4)吸收空气中的CO
2
和水蒸气
(5)使反应产生的CO
2
能与碱石灰充分反应,而被完全吸收偏小
(6)
53(m
3
-m
1
)
22m
×100%
2
-5-
推荐内容
-
A股港股全线杀跌怎么了?A股港股为何大跌?
A股,即人民币普通股票,是由中国境内注册公司发行,在境内上市,以人民币标明面值,供境内机构、组织或个人(2013年4月1日起,境内港澳台居
-
研究人员确定脂肪细胞中的卡路里燃烧途径
达纳法伯癌症研究所的研究人员与加州大学伯克利分校的科学家合作,确定了一种天然的分子途径,使细胞能够以热量的形式消耗卡路里,而不...
-
拜仁传奇射手盖德-穆勒去世 盖德·穆勒个人资料介绍
盖德·穆勒(Gerd Müller,1945年11月3日-2021年8月15日),出生于德国慕尼黑北埔小镇诺林根,前德国职业男子足球运动员,球员时代司职
-
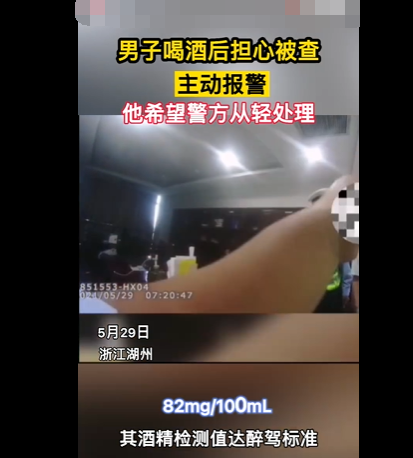
浙江男子打110举报自己酒驾 酒驾自首可以从轻处理吗?
浙江男子打110举报自己酒驾是怎么回事?什么情况?据最新消息显示,近日就有一则关于浙江男子打110举报自己酒驾的消息引起了网友们的关注,具
-
妇产科护理期末考试知识点
-2022年4月18日发(作者:尤伯杯2021赛程)妇产科护理二、女性生殖系统解剖1 外阴:由阴阜、大、小、及前庭组成。2 女性内生殖器位于真骨盆内
-
11月4日内蒙古自治区疫情最新数据公布 内蒙古昨日新增本土确诊病
提醒:疫情期间,请牢记新冠肺炎十大症状:发热(体温≥37 3℃)、干咳、乏力、嗅觉和味觉减退、鼻塞、流涕、咽痛、结膜炎、肌痛、腹泻...
-
最好的补肾壮阳方法
-2022年4月16日发(作者:胸疼是怎么回事)最好的补肾壮阳方法一、“交替浴”锻炼法:这是一种很古老的增强男人性功能的锻炼方法。用冷热...
-
39 风湿病科 浊瘀痹(痛风性关节炎)中医诊疗方案(2017年版)
-2022年4月17日发(作者:上海看皮肤过敏的医院)浊瘀痹(痛风性关节炎)中医诊疗方案(2017年版)一、诊断(一)疾病诊断1 中医诊断标准参照
-
10月22日额济纳旗达呼布镇疫情最新消息公布 昨日,内蒙古额济纳
内蒙古自治区,简称内蒙古,首府呼和浩特。地处中国北部,地理上位于北纬37°24′-53°23′,东经97°12′-126...
-
两性十大不同,男人女人各有各的样儿
-2022年4月18日发(作者:氧化锌的作用)两性十大不同,男人女人各有各的样儿10航行和意识不同的性别之间,接触事物的方式不同,据说,男性在