2019新课标全国三卷化学含答案
-
2019年普通高等学校招生全国统一考试(全国Ⅲ卷)
理科综合(化学)
可能用到的相对原子质量:H—24
12N—14O—16
Mg—1C—
P—31S—32Mn—55Fe—56
选择题:
7.化学与生活密切相关。下列叙述错误的是
A
.高纯硅可用于制作光感电池
B
.铝合金大量用于高铁建设
C
.活性炭具有除异味和杀菌作用
D
.碘酒可用于皮肤外用消毒
()
8.下列化合物的分子中,所有原子可能共平面的是
A
.甲苯
B
.乙烷
C
.丙炔
()
D
.
1,3
−丁二烯
9.X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最
外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是()
A
.熔点:
X
的氧化物比
Y
的氧化物高
B
.热稳定性:
X
的氢化物大于
Z
的氢化物
C
.
X
与
Z
可形成离子化合物
ZX
D
.
Y
的单质与
Z
的单质均能溶于浓硝酸
10
.离子交换法净化水过程如图所示。下列说法中错误的是()
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的NO
3
、SO2
4
、Cl通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应HOH
1
H
2
O
11
.设
N
A为阿伏加德罗常数值。关于常温下
pH2
的
H
3
PO
4
溶液,下列说法正确的
A
.每升溶液中的
H+数目为
0.02N
A
2cH
2
PO3cPO3cOH
4
2cHPO
44
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH
2
PO
4
固体,溶液酸性增强
12
.下列实验不能达到目的的是
选项
A
B
C
D
目的
制取较高浓度的次氯酸溶液
加快氧气的生成速率
除去乙酸乙酯中的少量乙酸
制备少量二氧化硫气体
实验
将Cl
2
通入碳酸钠溶液中
在过氧化氢溶液中加入少量MnO
2
加入饱和碳酸钠溶液洗涤、分液
向饱和亚硫酸钠溶液中滴加浓硫酸
13
.为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状
Zn3DZn可以高效
沉积
ZnO
的特点,设计了采用强碱性电解质的
3DZnNi0OH
二次电池,结构如下图
充电
ZnO(s)+2NiOH(s)。下列说法错误的所示。电池反应为2NiOOH(s)H
2
O(1)
2放电
是()
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为NiOH
2
s+OHaq-eNiOOHs+H
2
Ol
C.放电时负极反应为Zns+2OHaq-2eZnOs+H
2
Ol
D.放电过程中OH通过隔膜从负极区移向正极区
非选择题
26.(14分)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉
与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回
2
答下列问题:
1相关金属离子
c0Mn0.1mol?L
形成氢氧化物沉淀的pH范围如下:
金属离子
开始沉淀
的pH
沉淀完全
的pH
Mn2+
8.1
Fe2+
6.3
Fe3+
1.5
Al3+
3.4
Mg2+Zn2+
6.2
Ni2+
6.98.9
10.18.32.84.710.98.28.9
(1)“滤渣1”含有S和;写出“溶浸”中二氧化锰与硫化
锰反应的化学方程式。
(2)“氧化”中添加适量的MnO
2
的作用是。
(3)“调pH”除铁和铝,溶液的pH范围应调节为~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是。
(5)“除杂2”的目的是生成MgF
2
沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,
原因是。
(6)写出“沉锰”的离子方程式。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNi
x
Co
y
Mn
z
O
2
,
其中Ni、Co、Mn的化合价分别为2、3、4。当xy
1
时,z。
3
27.(14分)乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化
制备阿司匹林的一种方法如下:
熔点/℃
相对密度/(g·cm3)
相对分子质量
﹣
水杨酸
157~159
1.44
138
醋酸酐乙酰水杨酸
135~138
1.35
180
72~74
1.10
102
3
实验过程:在100mL锥形瓶中加入水杨酸6.9g及醋酸酐10mL,充分摇动使固体完全
溶解。缓慢滴加0.5mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进
行如下操作。
①在不断搅拌下将反应后的混合物倒入100mL冷水中,析出固体,过滤。
②所得结晶粗品加入50mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白的乙酰水杨酸晶体5.4g。
回答下列问题:
(1)该合成反应中应采用加热。(填标号)
A.热水浴
名称)。
B.酒精灯C.煤气灯D.电炉
(2)下列玻璃仪器中,①中需使用的有(填标号),不需使用的(填
(3)①中需使用冷水,目的是。
(4)②中饱和碳酸氢钠的作用是,以便过滤除去难
溶杂质。
(5)④采用的纯化方法为。
(6)本实验的产率是%。
28.(15分)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅
速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HClg+O
2
g=2Cl
2
g+2H
2
Og。下图为刚性
∶cO
2
分别等于11容器中,进料浓度比cHCl
∶1时HCl平衡转化率随温∶、7∶、41
度变化的关系:
4
可知反应平衡常数
K300℃K400℃(填
“
大于
”
或
“
小于
”
)。设
HCl
初
∶cO
2
11∶
的数据计算
K400℃=
始浓度为
c
0
,根据进料浓度比
cHCl
(列出计算式)。按化学计量比进料可以保持反应物高转化率,
同时降低产物分离的能耗。进料浓度比
c(HCl)
∶
c(O
2
)
过低、过高的不利影响分别
是。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl
2
s
1
CuCls+Cl
2
g
2
H
1
=83kJ·mol-1
1
CuCl(s)O
2
(g)
2
CuO(s)2HCl(g)
1
CuO(s)C
2
(g)H
2
20kJmol1
2
CuCl
2
(s)H
2
O(g)H
3
121kJmol1
则
4HClg+O
2
g2Cl
2
g+2H
2
Og的HkJmol1。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了
一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
负极区发生的反应有(写反应方程式)。电路中转移
1mol
电子,
需消耗氧气
L
(标准状况)。
36.[化学——选修5:有机化学基础](15分)
氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
5
回答下列问题:
(1)A的化学名称为。
(2)中的官能团名称是。
(3)反应③的类型为,W的分子式为。
(4)不同条件对反应④产率的影响见下表:
实验
1
2
3
4
5
6
碱溶剂催化剂产率/%
22.3
10.5
12.4
31.2
38.6
24.5
KOH
K
2
CO
3
Et
3
N
六氢吡啶
六氢吡啶
六氢吡啶
DMF
DMF
DMF
DMF
DMA
NMP
PdOAc
2
PdOAc
2
PdOAc
2
PdOAc
2
PdOAc
2
PdOAc
2
上述实验探究了和对反应产率的影响。此外,
还可以进一步探究等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简
式。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1mol的X与足
量金属Na反应可生成2gH
2
。
(
6
)利用
Heck
反应,由苯和溴乙烷为原料制备,写出合成路
线。(无机试剂任选)
7.
【答案】
C
【解析】
A
、硅是半导体,高纯硅可用于制作光感电池,
A
正确;
B
、铝合金硬度大,可用
于高铁建设,
B
正确;
C
、活性炭具有吸附性,可用于除异味,但不能杀菌消毒,
C
错误;
6
答案解析
D
、碘酒能使蛋白质变性,可用于皮肤外用消毒,
D
正确;答案选
C
。
【考点】化学与生活
8.
【答案】
D
【解析】
A
、甲苯中含有饱和碳原子,所有原子不可能共平面,
A
不选;
B
、乙烷是烷烃,
所有原子不可能共平面,
B
不选;
C
、丙炔中含有饱和碳原子,所有原子不可能共平面,
C
不选;
D
、碳碳双键是平面形结构,因此
1
,
3
-丁二烯分子中所有原子共平面,
D
选。答案
选
D
。
【考点】有机物
9.
【答案】
B
【解析】
Y
的最外层电子数等于
X
次外层电子数,由于均是主族元素,所以
Y
的最外层电
子数不可能是
8
个,则
X
只能是第二周期元素,因此
Y
的最外层电子数是
2
个,又因为
Y
的原子半径大于
Z
,则
Y
只能是第三周期的
Mg
,因此
X
与
Z
的最外层电子数是(
10
-
2
)
/2
=
4
,则
X
是
C
,
Z
是
Si
。
A
、碳的氧化物形成的分子晶体,
Y
的氧化物是离子化合物氧
化镁,则氧化镁的熔点高于碳的氧化物熔点,
A
错误;
B
、碳元素的非金属性强于硅元素,
非金属性越强,氢化物越稳定,则碳的氢化物稳定性强于硅的氢化物稳定性,
B
正确;
C
、
C
与
Si
形成的是共价化合物
SiC
,
C
错误;
D
、单质镁能溶于浓硝酸,单质硅不溶于浓硝酸,
D
错误;答案选
B
。
【考点】元素“位一构一性”的关系
10.
【答案】
A
【解析】离子交换树脂净化水的原理是:当含有Na+、Ca2+、
Mg
等阳离子及
SO
4
2+2-
、Cl-、
NO
3
-
等阴离子的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交
换的阳离子H+则被交换到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水
再通过阴离子交换树脂时,水中的阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也
被交换到水中,同时与水中的H+离子结合成水,则
A
、根据电荷守恒可知经过阳离子交换
树脂后,水中阳离子总数增加,
A
错误;
B
、根据以上分析可知水中的SO
4
2-
、Cl-、NO
3
-
等阴离子通过阴离子交换树脂被除去,
B
正确;
C
、通过净化处理后,溶液中离子的浓度降
低,导电性降低,
C
正确;
D
、根据以上分析可知阴离子交换树脂填充段存在反应
H++OH-H
2
O
,
D
正确;答案选
A
。
7
【考点】离子交换法的净水原理
11.
【答案】
B
【解析】
A
、常温下
pH=2
,则溶液中氢离子浓度是
0.01mol/L
,因此每升溶液中H+数目
为
0.01N
A
,
A
错误;
B
、根据电荷守恒可知选项
B
正确;
C
、加水稀释促进电离,电离度增大,但氢离子浓度减小,
pH
增大,
C
错误;
D
、加入
NaH
2
PO
4
固体,
H
2
PO
4
-
浓度增大,抑制磷酸的电离,溶液的酸性减弱,
D
错误;
答案选
B
。
【考点】查阿伏加德罗常数,电离平衡及其影响因素
12.
【答案】
A
【解析】
A
、氯气与碳酸钠溶液反应生成氯化钠、次氯酸钠和碳酸氢钠,不能制备次氯酸,
不能达到实验目的,
A
选;
B
、过氧化氢溶液中加入少量二氧化锰作催化剂,加快双氧水的
分解,因此可以加快氧气的生成速率,能达到实验目的,
B
不选;
C
、碳酸钠溶液与乙酸反
应,与乙酸乙酯不反应,可以除去乙酸乙酯中的乙酸,能达到实验目的,
C
不选;
D
、根据
较强酸制备较弱酸可知向饱和亚硫酸钠溶液中滴加浓硫酸可以制备二氧化硫,能达到实验目
的,
D
不选;答案选
A
。
【考点】化学实验方案
13.
【答案】
D
【解析】
A
、三维多孔海绵状
Zn
具有较高的表面积,吸附能力强,所沉积的
ZnO
分散度高,
A
正确;
B
、充电相当于是电解池,阳极发生失去电子的氧化反应,根据总反应式可知阳极
是
NiOH
2
失去电子转化为
NiOOH
,电极反应式为
NiOH
2
s+OH-aq-e-=NiOOHs+H
2
Ol,
B
正确;
C
、放电时相当于是原电池,
负极发生失去电子的氧化反应,根据总反应式可知负极反应式为
Zns+2OH-aq-2e-=ZnOs+H
2
Ol,
C
正确;
D
、原电池中阳离子向正极移动,阴
离子向负极移动,则放电过程中
OH-通过隔膜从正极区移向负极区,
D
错误。答案选
D
。
【考点】新型电池的工作原理
非选择题
26.
【答案】(
1
)
SiO
2
(不溶性硅酸盐)
8
MnO
2
+MnS+2H
2
SO
4
(
2
)将Fe2+氧化为Fe3+
(
3
)
4.7
(
4
)
NiS
和
ZnS
2MnSO
4
+S+2H
2
O
Mg2++2F平衡向右移动(
5
)F与H+结合形成弱电解质HF,MgF
2
2+(
6
)
Mn+2HCO
3
MnCO
3
+CO
2
H
2
O
(
7
)
【解析】(
1
)
Si
元素以
SiO
2
或不溶性硅盐存在,
SiO
2
与硫酸不反应,所以滤渣
I
中除了
S
还
有;在硫酸的溶浸过程中,二氧化锰和硫化锰发生了氧化还原反应,二氧化锰作氧化剂,硫
化锰作还原剂,方程式为:
MnO
2
+MnS+2H
2
SO
4
1
3
2MnSO
4
+S+2H
2
O
;
(
2
)二氧化锰作为氧化剂,使得
MnS
反应完全,且将溶液中Fe2+氧化为Fe3+;
(
3
)由表中数据知
pH
在
4.7
时,Fe3+和Al3+沉淀完全,所以应该控制
pH
在
4.7~6
之间;
(
4
)根据题干信息,加入
Na
2
S
除杂为了除去锌离子和镍离子,所以滤渣
3
是生成的沉淀
ZnS
和
NiS
;
H++F知,酸度过大,F浓度减低,使得MgF
2
Mg2++2F平衡向沉(
5
)由HF
2+淀溶解方向移动,Mg
沉淀不完全;
(
6
)根据题干信息沉锰的过程是生成了
MnCO
3
沉淀,所以反应离子方程式为
Mn2++2HCO
3
=MnCO
3
+CO
2
+H
2
O;
12x3y4z6
,xy(
7
)根据化合物中各元素化合价代数和为
0
的规律得:已知,
带入计算得:z
【考点】元素化合物间的相互特化与物质的分离提纯
27.
【答案】(
1
)
A
(
2
)
BD
9
1
,
3
1
3
分液漏斗、容量瓶
(
3
)充分析出乙酰水杨酸固体(结晶)
(
4
)生成可溶的乙酰水杨酸钠
(
5
)重结晶
(
6
)
60
【解析】(
1
)因为反应温度在
70
℃,低于水的沸点,且需维持温度不变,故采用热水浴的
方法加热;
(
2
)操作①需将反应物倒入冷水,需要用烧杯量取和存放冷水,过滤的操作中还需要漏斗,
则答案为:
B
、
D
;分液漏斗主要用于分离互不相容的液体混合物,容量瓶用于配制一定浓
度的溶液,这两个仪器用不到。
(
3
)反应时温度较高,所以用冷水的目的是使得乙酰水杨酸晶体充分析出;
(
4
)乙酰水杨酸难溶于水,为了除去其中的杂质,可将生成的乙酰水杨酸与碳酸氢钠反应
生成可溶性的乙酰水杨酸钠,以便过滤除去杂质;
(
5
)每次结晶过程中会有少量杂质一起析出,可以通过多次结晶的方法进行纯化,也就是
重结晶;
(
6
)水杨酸分子式为
C
7
H
6
O
3
,乙酰水杨酸分子式为
C
9
H
8
O
4
,根据关系式法计算得:
C
7
H
6
O
3
138
6.9g
C
9
H
8
O
4
180
m
mC
9
H
8
O
4
6.9g180/1389g
,则产率为
【考点】乙酰水杨酸制备
28.
【答案】(
1
)大于
5.4g
100%=60%
。
9g
(0.42)2(0.42)2
(10.84)4(10.21)c
0
O
2
和
Cl
2
分离能耗较高
HCl
转化率较低
(
2
)
116
(
3
)增加反应体系压强、及时除去产物
10
3(
4
)
FeeFe2,
4Fe2++O
2
+4H+4Fe3++2H
2
O
(
5
)
5.6
【解析】(
1
)根据反应方程式知,
HCl
平衡转化率越大,平衡常数
K
越大,结合图像知升
高温度平衡转化率降低,说明升高温度平衡向逆反应方向进行,则
K300℃>K400℃;
由图像知,
400
℃时,
HCl
平衡转化率为
84%
,用三段式法对数据进行处理得:
4HCl(g)O
2
(g)2Cl
2
(g)2H
2
O(g)
00起始(浓度)
c
0
c
0
变化(浓度)
0.84c
0
0.21c
0
0.42c
0
0.42c
0
0.42c
0
0.42c
0
平衡(浓度)10.84c
0
10.21c
0
(0.42)2(0.42)2
则
K
;根据题干信息知,进料浓度比过低,氧气大量剩余,导致
(10.84)4(10.21)c
0
分离产物氯气和氧气的能耗较高;进料浓度比过高,
HCl
不能充分反应,导致
HCl
转化率
较低;
2
得(
2
)根据盖斯定律知,(反应
I+
反应
II+
反应
III
)
×
4HCl(g)O
2
(g)2Cl
2
(g)2H
2
O(g)
△H=(△H
1
+△H
2
+△H
3
)?2=116kJ?mol-1;
(
3
)若想提高
HCl
的转化率,应该促使平衡正向移动,该反应为气体体积减小的反应,根
据勒夏特列原理,可以增大压强,使平衡正向移动;也可以及时除去产物,减小产物浓度,
使平衡正向移动;
(
4
)电解过程中,负极区即阴极上发生的是得电子反应,元素化合价降低,属于还原反应,
3+-
则图中左侧为负极反应,根据图示信息知电极反应为:
Fe+eFe2+和
4Fe2++O
2
+4H+4Fe3++2H
2
O
;电路中转移
1mol
电子,根据电子得失守恒可知需消耗氧
气的物质的量是
1mol4=0.25mol
,在标准状况下的体积为
0.25mol22.4L/mol=5.6L
。
【考点】反应热,电化学,化学平衡知识
11
36.
【答案】(
1
)间苯二酚(
1
,
3-
苯二酚)
(
2
)羧基、碳碳双键
(
3
)取代反应
C
14
H
12
O
4
(
4
)不同碱
不同溶剂
不同催化剂(或温度等)
(
5
)
(
6
)
【解析】
首先看到合成路线:由
A
物质经反应①在酚羟基的邻位上了一个碘原子,发生了取代反应
生成了
B
物质,
B
物质与丙烯酸在催化剂的作用下生成了
C
物质,那
C
物质就是将丙烯酸
中的羧基去掉取代了碘原子的位置;由
D
反应生成
E
就是把
HI
中的
H
连在了
O
上,发生
的是取代反应;最后
heck
反应生成
W
物质。(
1
)
A
物质所含官能团是两个酚羟基,且苯环
上有两个是间位的取代基,那物质的命名就是间苯二酚或
1
,
3-
苯二酚;
(
2
)物质中含有的官能团是碳碳双键和羧基
(
3
)
D
物质到
E
物质没有双键的消失,且在
O
原子处增加了氢原子,没有双键参与反应所
以属于取代反应,
W
物质中可以轻松数出共有
14
个
C
原子,
4
个氧原子,氢原子的个数可
以通过不饱和度来推断出,
14
个碳的烷应该有
30
个氢,现在该分子有
9
个不饱和度,其中
一个苯环
4
个,一个双键
1
个,一个不饱和度少
2
个氢,所以
309?2=12
,因此有
12
个
氢原子,即分子式为
C
14
H
12
O
4
。
12
(
4
)可以从表格中寻找溶剂一样的实验、碱一样的实验发现得出:实验
1
,
2
,
3
探究了不
同碱对反应的影响;实验
4
,
5
,
6
探究了不同溶剂对反应的影响,最后只剩下不同催化剂对
实验的影响。
(
5
)
D
的分子式为:
C
8
H
9
O
2
I
,要求含苯环,那支链最多含两个
C
,且
1molX
与足量
Na
反
应可生成
2g
氢气,那就证明有两个酚羟基或醇羟基,又有三种不同环境的氢
6
:
2
:
1
,那
一定是有两个甲基和两个酚羟基,因为醇羟基没有
6
个相同环境的氢,则符合条件的有机物
结构简式为。
(
6
)由题意中的
heck
反应可知需要一个反应物中含双建,一个反应物中含
I
;从苯出发可
以经过溴乙烷和溴化铁的反应制得乙苯,乙苯在乙基上通过烷烃的取代反应引入氯原子,卤
代烃在氢氧化钠醇溶液中发生消去反应产生双键,得到苯乙烯;可以仿照反应①通过相同条
件在苯环上引入一个碘原子,因此合成路线图为
。
【考点】有机合成
13
推荐内容
-
7月31日河南郑州疫情最新数据公布 郑州新增1例无症状感染者
郑州(Zhengzhou),简称郑,古称商都,是河南省省会、特大城市、中原城市群核心城市,国务院批复确定的中国中部地区重要的中心城市、国家重
-
误诊为脑膜炎的颅内肿瘤
-2022年4月24日发(作者:反应性关节炎)维普资讯健康大视野・医学分册2Oo6年1 1月 第1 1期Health Horizon・Med
-
蓝光照射辅以灌肠治疗新生儿高胆红素血症的疗效观察及护理
-2022年4月18日发(作者:肾盂肾炎症状)2010年第14卷第22期 实用临床医药杂志 Journal of Clinical Medi
-
股骨颈骨折术后护理康复指导
-2022年4月24日发(作者:健康证怎么办)股骨颈骨折术后护理及康复指导【摘要】目的股骨颈骨折多见于老年人,因一般老年质弱,骨折术后卧床时
-
女性不排卵是什么原因有哪些症状
-2022年4月18日发(作者:隆鼻手术最好的医院)女性不排卵的原因1、卵巢病变包括先天性卵巢发育不全,多囊卵巢综合症,卵巢功能早衰,卵巢肿
-
幼儿园小班《秋天的水果》教案
-2022年4月18日发(作者:非霍奇金淋巴瘤)幼儿园小班《秋天的水果》教案小班《秋天的水果》参考教案,活动目标是通过观察、触摸、品尝等方法
-
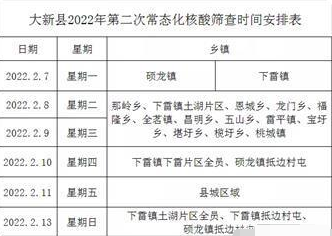
2月7日—13日大新县2022年第二次常态化核酸筛查时间表公布 广
提醒:疫情期间,请牢记新冠肺炎十大症状:发热(体温≥37 3℃)、干咳、乏力、嗅觉和味觉减退、鼻塞、流涕、咽痛、结膜炎、肌痛、腹泻...
-
沈阳一9岁男孩失联事件最新进展 沈阳一9岁男孩失联详情情况介绍
今天的你是否有在关注沈阳一9岁男孩失联的这个话题呢?具体是什么情况呢?下面跟小编一起来了解下事件始末。据央视新闻消息,12月10日11:08分
-
11月20日成都疫情最新消息公布 成都保利百合花园小区调整为低风
【导读】新冠肺炎疫情的出现,让人们的生活出现了或大或小的改变。在生活方式、习惯等方面的变化,有的会消失,而有的也许会长久地陪伴我们以
-
急性喉炎的健康宣教
-2022年4月22日发(作者:上海万圣节)急性喉炎的健康宣教概念急性喉炎是喉黏膜急性弥漫性卡他性炎症,亦称卡他性喉炎。病因1 因病毒、细菌感